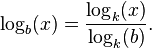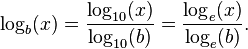لگاریتم
برای لگاریتم گرفتن بدون استفاده از ماشین حساب ،اعداد بنا بر رقم اولشون به سه دسته تقسیم می شن
("." نشان دهنده ی ممیزه)
***********************
الف) اگر رقم اول عدد 1 باشه :
تعداد ارقام بعد از ممیز - {1. (1 - تعداد ارقام)} = لگاریتم
به طور مثال لگاریتم عدد 10542 با این روش می شه
4.1 =0 -{ 1.(1 - 5 )}
که با مقدار واقعیش یعنی 4.023 اختلاف کمی داره.
یا مثلا لگاریتم عدد 0.123 می شه
0.9 - = 3 - { 1 . (1 - 3)}
که مقدار واقعیش هست 91 .0 -
************************
ب ) اگر رقم اول از اعداد 2 تا 7 باشه :
تعداد ارقام بعد از ممیز - (2 + رقم اول ) . (1 - تعداد ارقام) = لگاریتم
مثلا لگاریتم عدد 3542
5 .3 = 0 - { (2 + 3) .(1- 4) }
مقدار واقعیش 55. 3
***********************
ج) و در صورتیکه رقم اول از اعداد 8 و 9 باشد:
تعداد ارقام بعد از ممیز - 9 . (1 - تعداد ارقام) = لگاریتم
به عنوان مثال 8542
9. 3 = 9 . (1 - 4)
و مقدار واقعیش هست 3.93
برای محاسبه آنتی لگاریتم رابطه کلی زیر را داریم:
محاسبه ریشه اعداد :
در حالت کلی فرمول زیر را داریم:
ضرب، تقسیم، توان، ریشه[ویرایش]
لگاریتم حاصل ضرب چند عدد برابر است با مجموع لگاریتمهای تک تک آن عددها. لگاریتم نسبت دو عدد (تقسیم) برابر است با تفاضل لگاریتم آن دو عدد. لگاریتم توان p ام یک عدد برابر است با p برابر لگاریتم آن عدد. لگاریتم ریشهٔ p ام یک عدد برابر است با لگاریتم آن عدد تقسیم بر p. جدول زیر قوانین لگاریتم را همراه با یک نمونه نشان دادهاست:
| رابطه | نمونه | |
|---|---|---|
| ضرب |  |  |
| تقسیم |  | 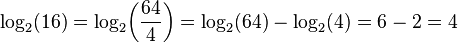 |
| توان | 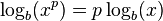 |  |
| ریشه | ![\log_b \sqrt[p]{x} = \frac {\log_b (x)} p \,](http://upload.wikimedia.org/math/3/c/a/3ca49ea6d6cf9ced59d76f8fc5e42755.png) | 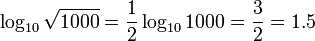 |
تغییر پایه[ویرایش]
میتوان 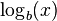 را به صورت غیر مستقیم با گرفتن لگاریتم x و b در یک پایهٔ دلخواه مانند k بدست آورد، به این ترتیب که:
را به صورت غیر مستقیم با گرفتن لگاریتم x و b در یک پایهٔ دلخواه مانند k بدست آورد، به این ترتیب که:
بیشتر ماشین حسابهایی که در دسترس اند لگاریتم را تنها در مبنای ۱۰ و عدد نپر[۳] محاسبه میکنند و لگاریتم در پایههای دیگر را به کمک رابطهٔ بالا محاسبه میکنند:
همچنین اگر عددی مانند x و مقدار لگاریتم آن را در یک مبنای نامشخص b داشته باشیم 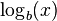 حال میتوان مبنای نامشخص b را به ترتیب زیر محاسبه کرد:
حال میتوان مبنای نامشخص b را به ترتیب زیر محاسبه کرد:
اگر دستتان را در نیتروژن مایع فرو ببرید
توجه: در این مطلب نکات ایمنی و جزئیات دقیق آزمایش ذکر نشده است، به همین دلیل تاکید میشود از انجام این آزمایش خودداری کنید، چراکه ذرهای خطا یا اشتباه میتواند به از دست رفتن دست شما منجر شود.
همانطور که در مطلب «فرو بردن انگشت درون سرب مذاب» اشاره شد، تئودور گری از خبرنگاران سایت پاپساینس عاشق انجام آزمایشهای عجیب است. یکی دیگر از آزمایشهای معروف وی فرو بردن دستش درون نیتروژن مایع است. خود وی با شوخطبعی خاصی درباره این آزمایش میگوید: «زمانیکه من برای نخستین بار این عکس از دست مردی را دیدم که درون نیتروژن مایع با دمایی حدود منفی ۱۹۵ درجه سانتیگراد فرو برده شده بود، بلافاصله با خود فکر کردم که این مرد باید دیوانه باشد! تنها کافی است که یک ثانیه دست خود را درون چنین مایعی قرار دهید و آنگاه به پوست جدیدی نیاز خواهید داشت. حتی این واقعیت که این دست خود من بود و ما این عکس را تنها چند لحظه قبل گرفته بودیم، نتوانست حیرتزدگی من را کم کند!»
گری میگوید که به طرز شگفتآوری وی حتی احساس سرما هم نکرد.
به همان دلیلی که قطرات آب بر روی یک ماهیتابه داغ جستوخیز میکنند، پوست دست وی هیچ صدمهای ندید. تقریبا به صورت بیدرنگ یک لایه عایق از بخار بین آب و فلز داغ شکل میگیرد که قطرات آب را نسبتا سرد نگه میدارد، بدون آنکه واقعا قطرات با سطح داغ تماس داشته باشند آنها را چند ثانیه روی هوا شناور نگه میدارد. در خصوص نیتروژن مایع، گوشت دست مثل ماهیتابه، سطح داغی است که دمای آن چند صد درجه بالای نقطه جوش آن است. بنابراین لحظهای که دست آزمایشگر با مایع تماس حاصل میکند، یک لایه محافظ از گاز نیتروژن تبخیر شده را ایجاد میکند؛ همانطور که ماهیتابه یک لایه بخار آب ایجاد میکند. این لایه زمان کافی را برای گری فراهم کرد تا دستش را درون نیتروژن مایع فرو ببرد و باز آن را بیرون بکشد. اگر تنها چند لحظه بیشتر دستش را درون نیتروژن نگاه میداشت، دست وی مسلما دچار سرمازدگی شدید میشد.

این پدید با نام اثر لیندنفراست شناخته میشود. نخستین بار، یوهان گاتلوب لیدنفراست، پزشک آلمانی قرن هجدهم بود که توانست این پدیده را توضیح دهد و آن را به نام خود ثبت کند. با استفاده از اثر لیدنفراست میتوان عکس این آزمایش را نیز انجام داد، یعنی میتوانید انگشت خود را نیز درون فلز مذاب فرو ببرید.
از نظر علمی، وقتی سطحی به اندازه کافی داغ باشد و مایعی روی آن ریخته شود، لایهای نازک از بخار بین سطح و مایع تشکیل میشود، این امر باعث کاهش تماس مایع با سطح و تأخیر در تبخیر آن میشود.
وقتی تماس و در نتیجه تبخیر کم شود، طبعا میزان دمای دریافتی از سطح بدن شخص هم کاهش پیدا میکند و فرد یخ نمیزند!
این پدیده را اصطلاحا اثر لیدنفراست Leidenfrost میگویند.
در این آزمایش، دمای بدن محمد آن نسبت به دمای نتیورژن آنقدر زیاد بود که باعث ایجاد همان پدیده شد.
همان طور که هشدار دادم، از تکرار آزمایش (به فرض اینکه به نیتروژن مایع دسترسی دارید!) پرهیز کنید
این مطلب از سایت شگفتیها کپی شده است: آزمایش شگفت انگیز فرو کردن دست در نیتروژن مایع | شگفتیها
از این وب سایتها هزاران جلد کتاب را رایگان دانلود کنید
به گزارش «تابناک» عاشقان دانلود کتاب های الکترونیک حتما با پروژه Gigapedia آشنا هستند. پروژه ای که میلیون ها جلد کتاب بروز و کلاسیک را به رایگان در اختیار کاربران قرار میداد و متاسفانه شکایت ناشران و نویسندگان مبنی بر نقض کپی راین منجر به آن شد که این پروژه دوست داشتنی برای همیشه از دسترس کار بران خارج شود. مصیبتی بزرگ حداقل برای دانشجویان ایرانی در آن زمان رقم خورد.
بعد از آن هیچ وب سایت و پروژه ای نتوانست جای این پروژه را بگیرد و هر چند وب سایت هایی در این میان یافت میشوند که اقدام به ارائه رایگان کتاب به کاربران میکنند، اما هیچ کدام جامعیت و بروز بودنGigapedia را ندارند با این حال هنوز هم جای امیدواری وجود دارد و برخی از این وب سایت ها همانگونه که ذکر شد، به شکل کاملا قانونی آثار بزرگ و کلاسیک را در اختیار کاربران قرار میدهند.
امروز قصد داریم شما را با چند نمونه از این وب سایت ها آشنا سازیم:

1 - FreeBook Sifter
اگر میدانید که به دنبال چه عنوان کتابی میگردید، در این وب سایت به احتمال زیاد به سادگی آن را پیدا خواهید کرد. میتوانید از دسته بندی جامع ارائه شده در وب سایت کمک گرفته و یا به سادگی به موتور جستجوی خوب آن رجوع کنید. این وب سایت به روزانه صدها عنوان کتاب جدید را به فهرست خود اضافه میکند:
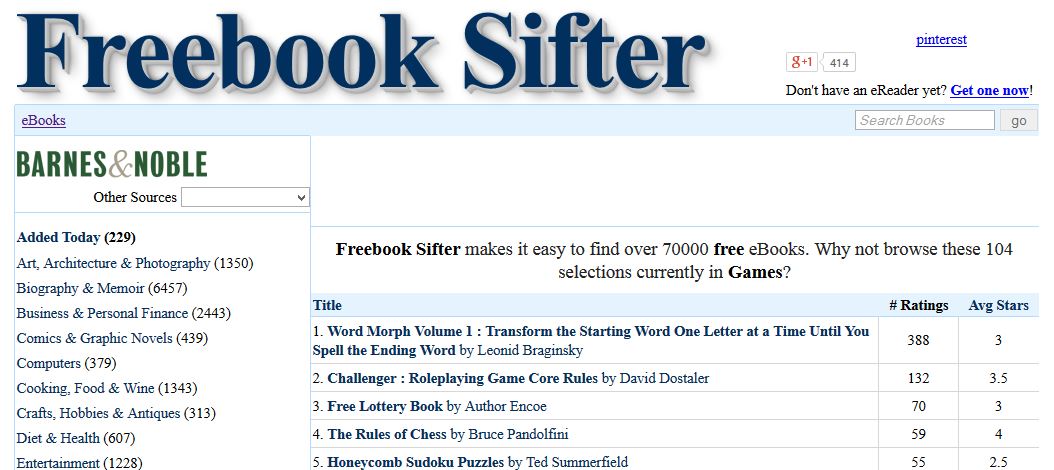
این وب سایت، عنوان ها را از آمازون و Barnes $ Noble استخراج میکند در نتیجه اکوسیستم آن با Kindleهمخوان است. اما این به این معنی نیست که شما نتوانید عناوین را دانلود کنید. به سادگی میتوانید یک نرم افزار Kindle را با یک جستجوی ساده در گوگل برای PC یا گوشی هوشمند و تبلت خود دانلود و از این وب سایت بهره ببرید. اینجا.
2 - Project Gutenberg
اگر به دنبال یک گزینه مطمئن تر و راحت تر میگردید، حتما به این وب سایت سر بزنید. این وب سایت هزاران جلد کتاب کلاسیک را در خود جای داده است و روزانه نیز چندین عنوان به فهرست خود اضافه میکند:
در این وب سایت همچنین عناوین مختلفی در قالب Audiobook یا کتاب صوتی ارائه میشود در نتیجه اگر شنیدن را به خواندن ترجیح میدهید، این یک گزینه فوق العاده برای شما خواهد بود. اینجا.
3 – Loyal Books
این وب سایت یک گزینه فوق العاده دیگر برای کتب کلاسیک است. همه کتاب های موجود بر روی این وب سایت به شکل قانونی و جزو اموال عمومی قرار دارد و میتوانید عناوین جالب توجهی را در اینجا پیدا کنید. منابع این وب سایت تقریبا بیش از 3 هزار جلد کتاب رایگان است که به همواره در حال بروز رسانی میباشد:
در این وب سایت میتوانید با استفاده از کلید واژه، نام مولف و یا عنوان کتاب مورد نظر خود را پیدا کنید یا اینکه در ژانر های مختلف گشت و گذار کنید. با کلیک بر روی هر عنوان، توضیحی در خصوص آن و همچنین مولف آن نیز برای شما نمایش داده خواهد شد. اینجا.
4 - NASA e-books
اگر به موضوعات علمی و تکنولوژیک علاقمند هستید، حتما به کتب این وب سایت سری بزنید و آنها را بررسی کنید. NASA هزاران جلد کتاب در مورد تاریخ و علم را در این وب سایت جمع آوری کرده و به رایگان و در چند فرمت مختلف در اختیار خوانندگان علاقمند قرار داده است. اینجا:
اما در پایان بگذارید یک معرفی دیگر در همین رابطه برای شما داشته باشیم. قطعا شما نیز به عنوان علاقمندان به کتاب و کتاب های دیجیتالی چندین و شاید چند صد جلد کتاب دیجیتالی دارید که در موارد خاص به آنها رجوع میکنید. پس نظر شما در خصوص داشتن یک کتابخانه نرم افزار چیست؟
نرم افزار Calibre یک کتابخانه دیجیتال است که میتواند کتاب های دیجیتال شما را دقیقا مشابه یک کتابخانه دسته بندی و مرتب کند. همچنین این قابلیت را دارد که مستندات شما را به فرمت های مختلف تبدیل کند. بهتر از همه آنکه اطلاعات هر کتاب را به شکل خودکار از روی نت برای شما فراهم میکند و بدون شک میتوان گفت که با داشتن این نرم افزار، یک کتابخانه قدرتمند دیجیتالی خواهید داشت.
برای دانلود این نرم افزار به اینجا مراجعه کنید.
http://www.tabnak.ir/
۹ نرم افزار Portable که هر کاربر حرفهای ویندوز باید داشته باشد
به گزارش «تابناک»، نکته جذاب و دوستداشتنی درباره برنامهها و نرمافزارهای Portable این است که اساسا هیچ نیازی به فرآیند نصب ندارند، به خوبی عمل میکنند، نیاز به مجوزهای دسترسی Admin ندارند و از همه مهمتر اینکه هیچ ردی از خود به جای نمیگذارند.
پس ما در اینجا شما را با چند نمونه نرمافزار Portable که میتوانید در جیب خود داشته باشید، تا مانند یک کاربر حرفهای ویندوز پشت هر سیستمی خیال شما را آسوده کند، آشنا میسازیم.

۱– فایرفاکس یا گوگل کروم
مرورگرهای Portable یکی از مهمترین گونههای این برنامهها هستند، زیرا به شما اجازه میدهند بدون به جای گذاشتن هیچ اطلاعات شخصی همچون تاریخچه وبگردی، کوکیها، اطلاعات حساب کاربری و مانند آن به گشت و گذار در نت بپردازید. در حالی که چندین مرورگر Portable وجود دارد، قطعا فایرفاکس –اینجا – و کروم – اینجا – بهترین نمونههای آنها هستند.
۲ – 7Zip
شاید هر جا و زمانی به این نیاز پیدا کنید که یک فایل فشرده را Extract نمایید یا تعدادی فایل را فشردهسازی کنید. ابزار قدرتمند 7Zip نسخهای Portable دارد – اینجا – که شما را از هر ابزار دیگری بینیاز میسازد.
۳ – GIMP
اگر یک گرافیست رایانهای هستید، قطعا با فتوشاپ زیاد سر و کار دارید. حال که فتوشاپ فاقد نسخهPortable است، نگران نباشید. میتوانید از نسخه Portable نرمافزار GIMP – اینجا – استفاده کنید که بیگمان جایگزین اصلی و بی رقیب فتوشاپ است.
۴ – ImgBurn
این ابزار – اینجا – به شما اجازه میدهد از CD و DVD اقدام به تهیه یک Image یا کپی به شکل فایلISO کنید. همچنین با این ابزار میتوانید فایلهای ISO را بر روی CD یا DVD به اصطلاح Write کنید.
۵ – VLC Media Player
به جرأت میتوان گفت که VLC یکی و شاید پرقدرتترین ابزارهای پخش ویدئوست و داشتن یک نسخهPortable – اینجا – منجر به آن میشود قدرت این ابزار همیشه در کنار شما باشد.
۶– Foxit Reader
در حالی که چندین ابزار برای خواندن فایلهای PDF به شکل Portable وجود دارد، اما نسخه Portable از ابزار Foxit Reader – اینجا – به دلیل داشتن امکانات وسیع و امنیت خوب ترجیح ما برای معرفی به شماست.
۷– CalmWin
هرگز نباید فراموش کرد، داشتن یک آنتی ویروس Portable تا چه حد میتواند کارساز باشد. از همین روی نسخه Portable آنتی ویروس CalmWin – اینجا – با قدرت شناسایی خوب، کمک بزرگی به شماست که خود را از شر بدافزارها در امان نگه دارید.
۸– SuperAntiSpayware
اما در کنار آنتی ویروس به یک ضد جاسوس خوب هم نیاز دارید تا احتمالا اطلاعات شخصی شما درز نکند. نسخه Portable ضد جاسوس SuperAntiSpyware – اینجا – یک گزینه مورد نظر شماست.
۹– Liber Office
این ابزار – اینجا – بهترین جایگزین Word است. با استفاده از این ابزار حتی قادر به ویرایش فایلهایWord و ذخیره با پسوند Doc و Docx نیز هستید.
منبع: تابناک
اعداد کوانتومی
در مکانیک موجی یا مکانیک کوانتومی، توزیع الکترون در اتمی که دارای چند الکترون باشد، به صورت لایههایی تقسیم شده است. این لایهها نیز شامل یک یا دو لایه فرعیاند و هر لایهی فرعی شامل یک یا چند اوربیتال است که به وسیله الکترونها اشغال شده است.
هر یک از الکترونهای یک اتم با مجموعهای از چهار عدد کوانتومی مشخص میشود که به صورت تقریبی بیانگر لایه، لایهی فرعی، اوربیتال و اسپین الکترون است.
از آنجا که شرودینگر الکترون را در فضای اطراف هسته در نظر گرفت، برای اینکه بتواند موقعیت یک الکترون را در فضای اطراف هسته مشخص کند از اعدادی استفاده کرد که به آن اعداد کوانتومی می گویند.
این اعداد عبارتند از: عدد کوانتومی اصلی، عدد کوانتومی اوربیتالی، عدد کوانتومی مغناطیسی و عدد کوانتومی اسپین
1-عدد کوانتومی اصلی (با حرف n نشان می دهیم )
عدد کوانتومی اصلی همان عددی است که بور برای مشخص کردن ترازهای انرژی مدل اتمی خود به کار می برد.
در مدل اتمی شرودینگر به جای ترازهای انرژی، لفظ لایه های الکترونی مورد استفاده قرار گرفت وn نیز سطح انرژی لایه ها را معین می کرد.
n=1 مربوط به پایدارترین لایه الکترونی است و هر چه nبزرگتر باشد لایه الکترونی از اتم دورتر و سطح انرژی آن زیادتر است.
پیرامون هسته اتم حداکثر 7 لایه الکترونی مشاهده شده است.
مواردی که از روی عدد کوانتومی اصلی می توان تشخیص داد:
1-شماره لایه اصلی
2-فاصله لایه اصلی از هسته
3-تعداد زیرلایه در لایه اصلی(شماره لایه اصلی با تعداد زیر لایه ها برابر است)
4-انرژی و پایداری لایه اصلی
الکترون ها در اطراف هسته در لایه های مختلفی حضور دارند. این لایه های الکترونی را از داخل به سمت خارج اتم، بـه ترتیب با اعداد کوانتومی (n یا عدد کوانتومی اصلی):
n=7, n=6, n=5, n=4, n=3, n=2, n=1
و یا با نماد های Q,P,O,N,M,L,K نشان می دهند. الـبته هر لایه ی الکترونی، از یک یـا چنـد زیرلایه تشکیل می شود. در حقیقت n ، تعداد، اندازه و میزان سطح انرژی زیرلایه ها را (در هر لایه) نشان می دهد. یعنی در لایه های دور تر ازهسـته، که n، عدد بزرگ تری است، تعداد زیرلایه ها، بیش تر و اندازه ی آن ها، بزرگ تر و سطح انرژی آن ها، بالاتر می باشد.
نکته:
هر لایه الکترونی مثل لایه ی n، دارای n2 اوربیتال است و حداکثر، گنجایش 2n2 الکترون را داراست. مثلاً لایه ی 1 (K)، دارای 1 اوربیتال است و حداکثر 2 الکترون را می تواند در خود جای دهد. هم چنین، لایه ی 2 (L)، دارای 4 اوربیتال است و حداکثر 8 الکترون را می تواند در خود جای دهد. لایه ی 3 (M)، نیز دارای 9 اوربیتال است و حداکثر 18 الکترون را می تواند در خود جای دهد و ...
2-عدد کوانتومی اوربیتالی (L):
هر لایه اصلی، شامل یک یا چند لایه فرعی یا تراز فرعی است. شمار لایههای فرعی در یک لایهی اصلی برابر با مقدار n است.
مثلا در لایه یک، فقط یک لایهی فرعی است و یا در لایهی دو، دو لایهی فرعی داریم.
مواردی که عدد کوانتومی اوربیتالی مشخص می کند:
1-نوع اوربیتال(s،p،d،f)
2-تعداد اوربیتالها که از فرمول (2L+1) بدست می آید.
3-شکل اوربیتال
کروی شکلs=
دمبلی شکل=p
Dوf به دلیل پیچیده بودن شکل هندسی خاصی نمی توان به آنها اخصاص داد.
L در لایهی فرعی با یک عدد کوانتومی فرعی (Subsidiary Quantum Number) یا ال (l) مشخص میشود.
مقادیر l برای لایههای فرعی با مقدار n لایهی اصلی تعیین میشود و می تواند مقادیری بین 0تاn-1 باشد
برای مثال اگر n برابر یک باشد، تنها مقدار l برابر صفر است و فقط یک لایهی فرعی داریم.
اگر n برابر 2 باشد، دو لایه فرعی یعنی صفر و یک و اگر n برابر 3 باشد، سه لایه فرعی یعنی صفر و یک و دو داریم.
که این مقادیر را با نمادهای s(L=0)، p(L=1)، d(L=2) ،f(L=3) نشان میدهند.
پس برای نمایش لایههای فرعی، از نمادهای زیر نیز استفاده میشود. یعنی:
لایه فرعی 0 با نماد s
لایه فرعی 1 با نماد p
لایه فرعی 2 با نماد d
لایه فرعی 3 با نماد f
چهار نشانهی نخست، حروف اول صفتهای تیز (Sharp)، اصلی (Principal)، پراکنده (Diffuse) و بنیادی (Fundamental) هستند که قبلاً برای مشخصکردن خطهای طیفی بهکار میرفتند.
برای مقادیر l بزرگتر از 3، این حروف به ترتیب الفبایی ادامه مییابد. یعنی g و h و i و غیره.
با ترکیب عدد کوانتومی اصلی با یکی از این حروف، راه سادهای برای مشخص کردن لایههای فرعی پیدا میشود. به عنوان مثال:
لایه n=2 و l=0 را لایهی فرعی 2s مینامند. یا
لایه n=2 و l=1 را لایهی فرعی 2p مینامند.
که به ترتیب داریم: 1s، 2s، 2p، 3s، 3p، 3d، 4s، 4p، 4d، 4f و الی آخر.
انرژی الکترونهای هر لایه با افزایش مقدار l افزایش مییابد برای مثال انرژی الکترونهای لایه n=3 به ترتیب افزایش برابر است با 3d>3p>3s
اوربیتال:
هر لایهی فرعی شامل یک یا چند اوربیتال است. تعداد اوربیتالها در یک لایهی فرعی طبق فرمول زیر محاسبه میشود:
تعداد اوربیتالها = 2l+1
برای مثال در لایه فرعی l=0 یک اوربیتال وجود دارد.
در لایه فرعی l=1 ، سه اوربیتال وجود دارد.
در لایه فرعی l=2 پنج اوربیتال وجود دارد.
بنابراین لایه فرعی s شامل یک اوربیتال، لایه فرعی p شامل سه اوربیتال، لایه فرعی d شامل پنج اوربیتال و لایه فرعی f شامل هفت اوربیتال است و الی آخر.
در هر اوربیتال 2 الکترون قرار میگیرد.
3-عدد کوانتومی مغناطیسی(ml):
این عدد جهت گیری اوربیتالها در فضا را معین می کند.
هر یک از اوربیتالهای یک لایهی فرعی، با عدد کوانتومی مغناطیسی اوربیتال یا ml مشخص میشود.
عدد کوانتومی مغناطیسی همه اعداد بین+Lتا-L را شامل می شود.
(هر زیر لایه 2L+1اوربیتال دارد و تنها وجه تمایز اوربیتالها در یک زیر لایه جهت گیری آنها است.)
مثلا
برای l=0 تنها مقدار مجاز ml، صفر است (یک اوربیتال s).
برای l=1 مقدار مجاز ml میتواند -1, 0, +1 باشد (سه اوربیتال p).برای l=2 مقدار مجاز ml میتواند -2, -1, 0, +1, +2 باشد (پنج اوربیتال d).
4-عدد کوانتومی مغناطیسی اسپین(ms):
هر الکترون علاوه بر این که به دور هسته چرخش می کند به دور محور خود نیز می گردد که به چرخش الکترون به دور محور خود حرکت اسپینی می گویند.
عدد کوانتومی مغناطیسی اسپینی یک الکترون میتواند یکی از دو مقدار زیر را دارا باشد:
Ms = +1/2 or -1/2
در هر اوربیتال فقط دو الکترون می تواند جای بگیرد. چون دو الکترون بار منفی دارند و برای این که در یک اوربیتال قرار بگیرند بایذ با اسپین مخالف(+1/2 و -1/2) کنار هم قرار بگیرند تا قطبهای مغناطیسی مخالفS و N هم دیگر را جذب کنندو باعث قرار گرفتن دو الکترون در یک خانه شوند.
خلاصه:
هر اتم را با چهار اتم کوانتومی میتوان توصیف کرد:
1) n که بیانگر لایه و فاصلهی نسبی الکترون از هسته است.
2) l که بیانگر لایه فرعی و شکل اوربیتال الکترون است. در غیاب میدان مغناطیسی، اوربیتالهای یک لایهی فرعی معین از لحاظ انرژی همارزند.
3) ml که بیانگر جهتگیری اوربیتال است.
4) ms که بیانگر اسپین الکترون اشاره دارد.
http://daneshnameh.roshd.ir/mavara/mavara-index.php?page=%D8%A7%D8%B9%D8%AF%D8%A7%D8%AF+%DA%A9%D9%88%D8%A7%D9%86%D8%AA%D9%88%D9%85%DB%8C&SSOReturnPage=Check&Rand=0
http://iut90.blogfa.com/post/370
http://s-shimy.persianblog.ir/post/13/
http://chemistry3vom.mihanblog.com/post/24